La transición adiabática entre dos estados en gases no es uno de los isoprocesos, sin embargo, juega un papel importante no solo en varios procesos tecnológicos, sino también en la naturaleza. En este artículo, consideraremos qué es este proceso y también daremos las ecuaciones adiabáticas para un gas ideal.
Resumen del gas ideal
Un gas ideal es aquel en el que no hay interacciones entre sus partículas, y sus tamaños son iguales a cero. En la naturaleza, por supuesto, no existen gases cien por cien ideales, ya que todos están compuestos por moléculas y átomos de tamaño, que siempre interactúan entre sí al menos con la ayuda de las fuerzas de van der Waals. Sin embargo, el modelo descrito a menudo se realiza con suficiente precisión para resolver problemas prácticos para muchos gases reales.
La ecuación principal de un gas ideal es la ley de Clapeyron-Mendeleev. Se escribe de la siguiente forma:
PV=nRT.
Esta ecuación establece una proporcionalidad directa entre el productopresión P sobre el volumen V y la cantidad de sustancia n sobre la temperatura absoluta T. El valor de R es la constante de gas, que juega el papel de un factor de proporcionalidad.
¿Qué es un proceso adiabático?
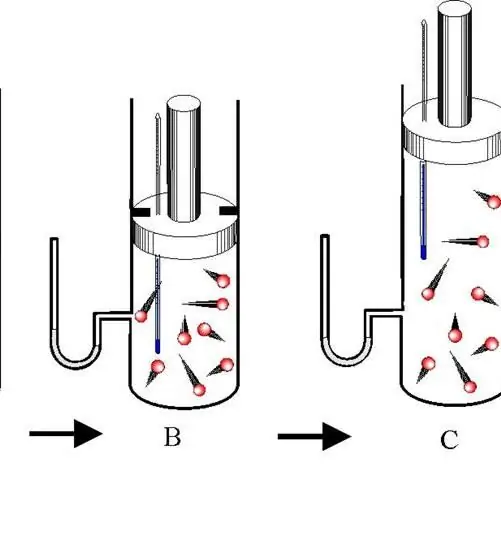
Un proceso adiabático es una transición entre los estados de un sistema gaseoso en el que no hay intercambio de energía con el medio ambiente. En este caso, las tres características termodinámicas del sistema (P, V, T) cambian y la cantidad de sustancia n permanece constante.
Distinguir entre expansión y contracción adiabática. Ambos procesos ocurren solo debido a la energía interna del sistema. Entonces, como resultado de la expansión, la presión y especialmente la temperatura del sistema caen dramáticamente. Por el contrario, la compresión adiabática da como resultado un s alto positivo en la temperatura y la presión.
Para evitar el intercambio de calor entre el ambiente y el sistema, este último debe tener paredes aisladas térmicamente. Además, al acortar el tiempo del proceso se reduce significativamente el flujo de calor hacia y desde el sistema.
Ecuaciones de Poisson para un proceso adiabático

La primera ley de la termodinámica se escribe de la siguiente manera:
Q=ΔU + A.
En otras palabras, el calor Q comunicado al sistema se usa para realizar un trabajo A por parte del sistema y para aumentar su energía interna ΔU. Para escribir la ecuación adiabática se debe poner Q=0, que corresponde a la definición del proceso en estudio. Obtenemos:
ΔU=-A.
Con isocoroproceso en un gas ideal, todo el calor se destina a aumentar la energía interna. Este hecho nos permite escribir la igualdad:
ΔU=CVΔT.
Donde CV es la capacidad calorífica isocórica. El trabajo A, a su vez, se calcula de la siguiente manera:
A=PdV.
Donde dV es un pequeño cambio de volumen.
Además de la ecuación de Clapeyron-Mendeleev, la siguiente ecuación es válida para un gas ideal:
CP- CV=R.
Donde CP es la capacidad calorífica isobárica, que siempre es mayor que la isocórica, ya que tiene en cuenta las pérdidas de gas por dilatación.
Analizando las ecuaciones escritas anteriormente e integrando la temperatura y el volumen, llegamos a la siguiente ecuación adiabática:
TVγ-1=const.
Aquí γ es el índice adiabático. Es igual a la relación entre la capacidad calorífica isobárica y la isocórica. Esta igualdad se llama la ecuación de Poisson para un proceso adiabático. Aplicando la ley de Clapeyron-Mendeleev, puedes escribir dos expresiones similares más, solo a través de los parámetros P-T y P-V:
TPγ/(γ-1)=constante;
PVγ=const.
El gráfico adiabático se puede dar en diferentes ejes. A continuación se muestra en ejes P-V.
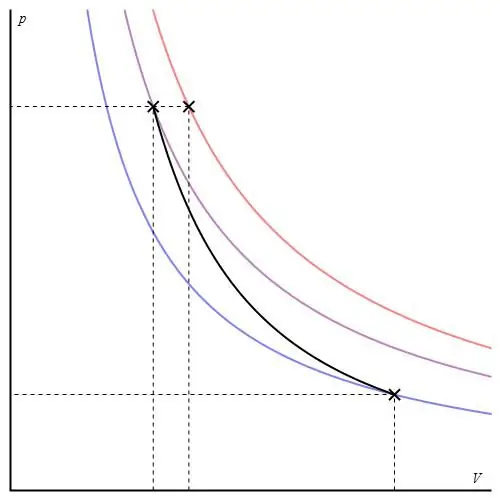
Las líneas de colores en el gráfico corresponden a isotermas, la curva negra es una adiabática. Como puede verse, la adiabática se comporta de forma más brusca que cualquiera de las isotermas. Este hecho es fácil de explicar: para la isoterma, la presión vuelve a cambiarproporcional al volumen, pero para la isóbata, la presión cambia más rápido, ya que el exponente es γ>1 para cualquier sistema de gas.
Problema de ejemplo
En la naturaleza, en las zonas montañosas, cuando la masa de aire asciende por la ladera, su presión desciende, aumenta de volumen y se enfría. Este proceso adiabático reduce el punto de rocío y produce precipitaciones líquidas y sólidas.

Se propone resolver el siguiente problema: en el proceso de levantamiento de la masa de aire a lo largo de la ladera de la montaña, la presión cayó un 30% en comparación con la presión al pie. ¿A qué era igual su temperatura si al pie estaba a 25 oC?
Para resolver el problema, usa la siguiente ecuación adiabática:
TPγ/(γ-1)=const.
Es mejor escribirlo de esta forma:
T2/T1=(P2/P 1)(γ-1)/γ.
Si P1 se toma como 1 atmósfera, entonces P2 será igual a 0,7 atmósferas. Para el aire, el índice adiabático es 1,4, ya que puede considerarse un gas ideal diatómico. El valor de temperatura de T1 es 298,15 K. Sustituyendo todos estos números en la expresión anterior, obtenemos T2=269,26 K, que corresponde a - 3, 9 oC.






