El conocimiento de las definiciones en física es un factor clave para resolver con éxito varios problemas físicos. En el artículo, consideraremos qué se entiende por procesos isobáricos, isocóricos, isotérmicos y adiabáticos para un sistema de gas ideal.
Gas ideal y su ecuación
Antes de pasar a la descripción de los procesos isobáricos, isocóricos e isotérmicos, consideremos qué es un gas ideal. Bajo esta definición en física consideran un sistema formado por una gran cantidad de partículas adimensionales y que no interactúan que se mueven a altas velocidades en todas las direcciones. De hecho, estamos hablando de un estado de agregado gaseoso de la materia, en el que las distancias entre los átomos y las moléculas superan con creces sus tamaños y en el que la energía potencial de interacción de las partículas se desprecia debido a su pequeñez, en comparación con la energía cinética.
El estado de un gas ideal es la totalidad de sus parámetros termodinámicos. Los principales son la temperatura, el volumen y la presión. Vamos a denotarlos con las letras T, V y P, respectivamente. En los años 30 del siglo XIXClapeyron (un científico francés) primero escribió una ecuación que combina los parámetros termodinámicos indicados dentro de una sola igualdad. Parece:
PV=nRT,
donde n y R son la cantidad de sustancias y la constante de los gases, respectivamente.
¿Qué son los isoprocesos en los gases?
Como muchos han notado, los procesos isobáricos, isocóricos e isotérmicos usan el mismo prefijo "iso" en sus nombres. Significa la igualdad de un parámetro termodinámico durante el transcurso de todo el proceso, mientras que los parámetros restantes cambian. Por ejemplo, un proceso isotérmico indica que, como resultado, la temperatura absoluta del sistema se mantiene constante, mientras que un proceso isocórico indica un volumen constante.
Los isoprocesos son convenientes para estudiar, ya que la fijación de uno de los parámetros termodinámicos conduce a una simplificación de la ecuación general de estado de los gases. Es importante señalar que las leyes de los gases para todos estos isoprocesos se descubrieron experimentalmente. Su análisis permitió a Clapeyron obtener la ecuación universal reducida.
Procesos isobáricos, isocóricos e isotérmicos
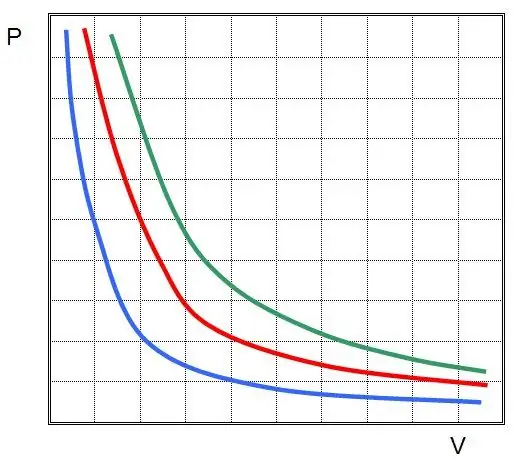
Se descubrió la primera ley para un proceso isotérmico en un gas ideal. Ahora se llama la ley de Boyle-Mariotte. Como T no cambia, la ecuación de estado implica la igualdad:
PV=const.
En otras palabras, cualquier cambio en la presión en el sistema conduce a un cambio inversamente proporcional en su volumen, si la temperatura del gas se mantiene constante. La gráfica de la función P(V) eshipérbole.
Proceso isobárico: este es un cambio en el estado del sistema, en el que la presión permanece constante. Habiendo fijado el valor de P en la ecuación de Clapeyron, obtenemos la siguiente ley:
V/T=const.
Esta igualdad lleva el nombre del físico francés Jacques Charles, quien la recibió a finales del siglo XVIII. La isobara (representación gráfica de la función V(T)) parece una línea recta. Cuanta más presión haya en el sistema, más rápido sube esta línea.
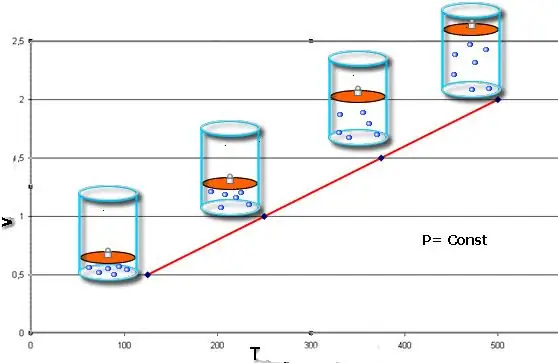
El proceso isobárico es fácil de implementar si el gas se calienta debajo del pistón. Las moléculas de este último aumentan su velocidad (energía cinética), crean una mayor presión sobre el pistón, lo que provoca la expansión del gas y mantiene un valor constante de P.
Finalmente, el tercer isoproceso es isocórico. Funciona con un volumen constante. De la ecuación de estado obtenemos la igualdad correspondiente:
P/T=const.
Es conocida entre los físicos como ley de Gay-Lussac. La proporcionalidad directa entre la presión y la temperatura absoluta indica que la gráfica del proceso isocórico, al igual que la gráfica del isobárico, es una línea recta con pendiente positiva.
Es importante entender que todos los isoprocesos ocurren en sistemas cerrados, es decir, el valor de n se conserva durante su curso.
Proceso adiabático
Este proceso no pertenece a la categoría "iso", ya que los tres parámetros termodinámicos cambian durante su paso. adiabáticollamado la transición entre dos estados del sistema, en el que no intercambia calor con el medio ambiente. Así, la expansión del sistema se lleva a cabo debido a sus reservas internas de energía, lo que provoca una importante caída de presión y temperatura absoluta en el mismo.
El proceso adiabático para un gas ideal se describe mediante las ecuaciones de Poisson. Uno de ellos se muestra a continuación:
PVγ=constante,
donde γ es la relación entre las capacidades caloríficas a presión constante y a volumen constante.
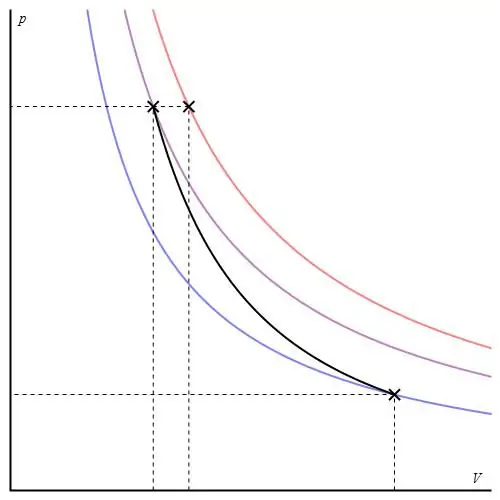
El gráfico adiabático difiere del gráfico de proceso isocórico y del gráfico isobárico, pero es similar a una hipérbola (isoterma). La adiabática en los ejes P-V se comporta de forma más brusca que la isoterma.






